发布时间:2019-04-10 14:23 来源:中国知网
随着分子生物学技术的不断发展和大量应用, 以PCR技术为基础的食品溯源检测、掺伪检测和GMO成分分析快速发展, 但食品加工过程中的多种因素会对原材料DNA造成巨大影响, 导致DNA一级结构被破坏, 使DNA水解、氧化或脱氨基, 影响PCR的定性或定量检测, 造成检测结果不稳定或失败。同时, 加工食品的DNA提取方法也会影响检测结果。如何最大限度地获得加工食品中的原料DNA, 去除多糖、多酚、蛋白质等对后续PCR过程的影响或抑制, 也成为食品安全分子检测的重要考虑因素。
本文总结了近年来国内外针对加工食品的DNA提取、检测及检测方法, 并进行简要分析, 以期为我国食品安全检测、食品溯源和GMO成分分析的进一步发展提供理论参考。
1 加工食品DNA提取影响因素
进行加工食品检测的第一步是提取DNA。DNA的品质 (数量、纯度) 决定后续检测效果。对于单一原料食品, 如豆腐、玉米片等, 可以认为原料同一, 则提取难度降低。但对于复合原料食品, 如饼干、披萨等, 原料的复杂性会导致DNA提取难度上升。在这类食品的处理过程中, 就需要确定主要检测原料, 并制订相应提取方案。
一般情况下, 加工食品的植物性原材料DNA提取利用CTAB (十六烷基三甲基溴化铵) 方法进行, 该方法具有去除植物性多糖和成本低廉的优势。另外, 也有利用磁珠富集的方式进行DNA提取, 产物直接进行PCR扩增。但由于食品加工过程的许多因素都可以造成DNA降解, 导致DNA纯度或浓度下降, 因而在提取过程中通常考虑这2个因素的折中方案。表1总结了前人进行食品DNA提取中的优化方案, 这些方案通过凝胶成像、UV分光光度计、荧光检测、传统PCR、巢式PCR或RT-PCR等方法进行验证, 获得最优结果。
表1 CTAB抽提法对食品DNA提取方案的验证

食品中存在许多化学成分, 这些化学成分会影响DNA的提取。如各种杀菌剂加工过程中物理性质或化学性质的改变, 使DNA附着在非溶解性物质上, 降低DNA的抽提效果;氧化剂或酶水解缩短DNA长度。加工过程中的一些处理, 如加热、冷冻等, 也会降低DNA片段长度, 从而改变DNA提取效率。
2 DNA的数量、纯度与PCR的关系
DNA的数量与纯度决定PCR扩增效率。一般通过检测DNA片段长度或平均分子量来判断所提DNA的质量, 而DNA的质量与所检材料种类、加工过程和DNA提取方法相关。在转基因食品检测中, 通过PCR扩增目标片段 (外源基因片段) 分析是否为转基因加工食品。
食品基质中存在的大量化学物质对于DNA纯度有严重影响。DNA提取过程的选择和优化, 可以消除潜在干扰和反应抑制物, 使基于DNA基础的检测技术获得成功。首先, 原料自身包含的蛋白质、多糖、脂类或多酚可能引起DNA污染;其次, 提取DNA时所用的CTAB、EDTA、酚类、氯仿、SDS、乙醇、异丙醇等, 都会干扰Taq酶活性, 从而抑制PCR反应;再次, 缓冲液中包含的盐类、糖类以及其他化合物也会不同程度地降低PCR反应效率。因此, 在进行加工食品PCR扩增时, 往往需要稀释DNA提取液, 通过降低干扰物的浓度来提高PCR反应效率。通过分光光度计进行DNA纯度检测, 确定在230、260、280 nm处的吸光值, 计算A260/A280和A260/A230。当A260/A280吸收值为1.5~2.0、A260/A230超过1.7时, 所提取DNA适用于PCR反应。众多研究发现, 用于PCR的样品需要DNA的数量在20~200 ng之间, 浓度过高影响反应效率, 而过低则容易导致扩增失败。
加工食品中往往包含多种原材料, 并且经过多重工序。由于原材料的特性不同, 就会影响DNA的提取效率。对于不同食品, 往往无法适用一种或几种通用的提取方法, 需要根据不同材料优化不同提取过程。
3 目标片断选择和引物设计与PCR的关系
提取DNA是为了进行后续的PCR检测。普通PCR是使用最普遍的一种分子检测手段。一般认为, 普通PCR作为一种定性分析手段, 对目标片段有很好的扩增性。表2总结了大豆转基因食品PCR评估DNA方法。另外, 在小麦、精炼菜籽油、马铃薯加工等加工食品的研究中也常用普通PCR进行。
表2 利用普通PCR评估豆制品加工过程中的DNA变化
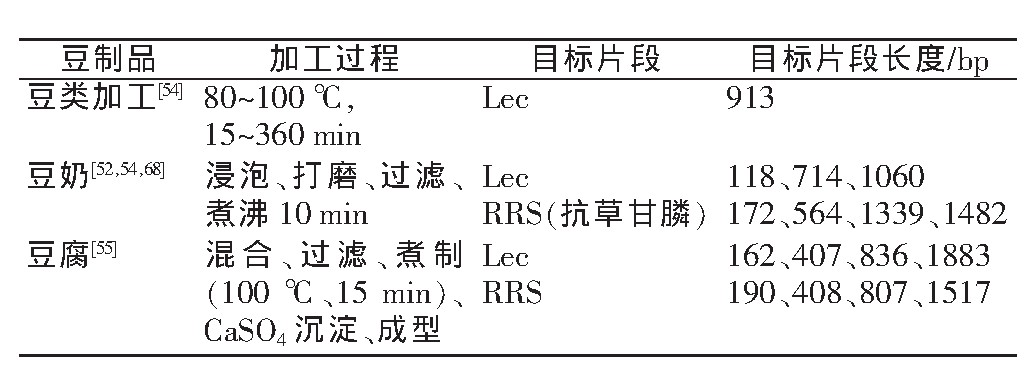
与其他材料的PCR过程相似, 加工食品DNA检测的PCR过程, 其引物序列、引物浓度、酶、体系大小和程序设定都会对检测结果有重要影响。而由于加工食品的DNA随着加工步骤的不断进行已经出现不同程度的降解, 终产品的目标片段长度往往仅有100~300 bp, 因而目标片段选择和引物设计至关重要。
4 加工过程对原材料DNA的影响
加工过程种类繁多, 温度、pH值、微生物发酵等均对食品原材料的DNA有影响, 不同材料对于不同的加工过程也会有不同的降解效率, 从而影响后续PCR反应。因此, 了解不同加工过程对不同原料DNA的影响十分关键。
4.1 温度
高温容易使DNA发生物理降解, 即变性, 其作用机理是高温引起DNA的脱氨基或脱嘌呤作用。虽然高于100℃会导致DNA链断裂, 二级结果被破坏, 但高温灭菌或灌制时使用121℃进行15 min处理并不会导致全部DNA破坏。因此, 这种加工过程处理后的食品, 进行DNA有效提取后仍可进行PCR扩增反应。但如果再有后续的烹煮、烘烤、干燥等加热过程, 会引起DNA的进一步降解, 而这些过程会导致DNA被切断成小片段, 使PCR效率降低。
4.1.1 干热加工。
高温伴随干燥过程对DNA影响很大。在薯片制作过程中, 70℃、2 h烘干会导致马铃薯DNA降解。而温度越高, DNA的降解速率越快。94℃、5 min烘烤玉米过程就会导致玉米DNA 577 bp大小的片段全部消失;同时, 研究人员发现, 在玉米片加工过程中100℃烘烤会导致玉米基因组DNA降解, 但大部分经过烘烤加工的食品中仍有小分子片段存在, 使PCR扩增成为可能。
4.1.2 湿热加工。
Ogasawara等对比利用干豆和湿豆制作豆奶制品的过程, 同样是100℃60 min以上的处理, 干豆DNA未出现明显的改变, 而湿豆的830 bp和1 022 bp片段都发生严重降解。加热DNA溶液是影响DNA片段最简便的方法 (通过改变时间和温度) 。Hupfer等发现, 95℃60 min后, DNA片段长度损失600 bp以上。同样, Debode等发现, 在99℃7 h烹煮后, DNA平均片段仍保持在400 bp。微波处理0~15 min 800 W条件下, 每次保持最长时间 (15 min) 3次, 中间冷却, 会导致DNA严重降解, 但DNA片段大小仍大于目标片段。
煮沸过程中添加化学成分也会增加DNA的损失。在玉米粉制作过程中, 添加1%石灰粉煮沸20 min, 这一联合效果使DNA片段降解到585 bp以下。但后续沉降蛋白质所加入酸和氯化钙并不会导致DNA进一步降解。但在豆腐制作过程中, 酸和CaCl2的添加并未影响目标595 bp大片段的扩增。在polenta (一种玉米淀粉制作的粥状食物) 制作过程中, 玉米面粉溶解在0.4%氯化钠溶液中30 min煮沸, 1 914 bp片段消失, 然而211 bp片段在105 min加热后仍可检测到。这些结果均显示, 水煮加热时间越长, 对片段的降解程度越高。
4.1.3 油炸。
在薯片的加工过程中, 植物DNA在175℃3 min和150℃1 min下严重降解, 只有96 bp片段能够被扩增 (终产品中)。然而在油豆腐中, 175℃对其影响比较小, 595 bp扩然增仍然能被扩增。另外, 对比油炸湿masa和烤干masa, 油炸湿masa降解较低, 表明水分的存在缓冲了油炸的热冲击。
4.2 pH值
4.2.1 酸性环境。
水果或蔬菜的汁液通常均为酸性环境, 或处理过程中环境为酸性。如番茄汁, pH值在4.0~4.4之间。DNA在酸性环境下, 纯度下降, 同时导致DNA断裂。在酸性环境下, 辅以热处理也会加速酸催化反应。Bauer T等发现, 在番茄酱制作过程中, pH值为4.3、温度为65℃时会导致DNA快速降解。在面粉发酵过程中, 由于酵母菌发酵降低面团pH值, 使小麦DNA出现酸降解现象。湿磨玉米 (酸性环境下浸泡) 比单独湿磨玉米更容易使DNA降解。
4.2.2碱性环境。
相比酸性环境, DNA在碱性环境下稳定性较高。pH值为8.5~9.5之间时, DNA双螺旋结构解链, 但并不会断裂。在墨西哥卷饼制作的最初阶段, 需要添加pH值较高的溶液同时加热, 形成pH值为11.0的加热水溶液, 这一过程导致DNA降解。在墨西哥, 许多食物 (如tortilla, 玉米片、taco shells) 均需要这种碱性溶液加热处理。Kharazmi等发现, 585 bp片段扩增失败, 但Hupfer却发现, pH值9.0加热60 min, 仍能够检测到1914 bp片段大小DNA。
4.3 发酵
在发酵过程中, 由于微生物以食品原材料为原料进行消化代谢, 所产生的DNA酶对DNA有强烈降解效果。Pan等发现, miso (日本豆面酱) 的制作过程中经过120 d的发酵后, 35 S启动子无法检测到。发酵结束放置5~6个月的miso中, DNA片段降解到200 bp以下。通过普通PCR和巢式PCR, 可以检测到95 bp大小的DNA片段。因此, 巢式PCR技术对于降解成小片段的DNA有更好的扩增效果。
4.4 机械力作用
在食品加工过程中, 物理作用 (如打磨、压榨) 也会使DNA原始片段出现断裂。尤其在豆类加工制品、各种面粉的制作过程中, 打磨是最基础、最初的步骤, 这些物理作用力将DNA降解成小片段, 破坏DNA结构。
对预包装食品往往进行辐照灭菌, 以延长其货架期。辐照射线也会对食品中的DNA产生强烈影响。Villavicencio等对豆粕制品施以1 000 Gy强度的辐照, DNA的破坏程度与辐照强度成正比。
5 结论与展望
食品加工过程中的许多过程都会影响DNA的各级结构。其中高温和酸度是破坏DNA结构的最主要因素。随着PCR技术的不断发展, 利用各种变异型的PCR技术 (如荧光定量PCR、巢式PCR技术等) , 使被降解为小分子的DNA片段检测成为可能。但为了提高检测的成功率和灵敏性, 目标片段的选择成为关键因素。
由于人们对食品安全的关注度越来越高, 食品掺伪、溯源和GMO检测成为食品安全检测的重要发展方向, 利用分子生物学手段进行原料检测, 使食品安全检测更加快速、准确。但由于食品加工过程中的各种过程会对原材料DNA分子造成破坏。因此, 了解各种加工过程对DNA的影响, 尤其是常见的、重要的加工过程, 对于不同食品原料的影响, 在产品溯源和GMO检测时显得非常关键。
未来, 在食品原材料的分子检测中, 最应关注的是小目标片段的筛选以及针对不同食品建立特异性强的目标片段及对应引物体系, 检测确定在加工过程中各食品原材料的更稳定基因, 同时结合近年来发展起来的蛋白组学、转录组学和核酸适配体等技术, 为食品安全检测提供更加便捷、准确的方法革新。
责任编辑:小雪